厦门逸漠生物科技有限公司品牌商
6 年
手机商铺
- NaN
- 0.7999999999999998
- 0.7999999999999998
- 2.8
- 2.8
推荐产品
技术资料/正文
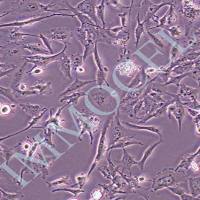
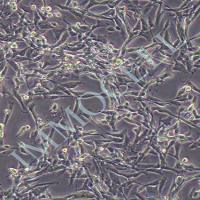
来自野生型和连接蛋白43基因敲除小鼠的永生化小鼠皮质星形胶质细胞的生成和鉴定
299 人阅读发布时间:2022-12-20 11:58
今天推荐的是由美国阿尔伯特爱因斯坦医学院在2021年发表于Frontiers in Cellular Neuroscience (2021 IF 6.147, JCR/Q1)的一篇文章,通讯作者是Mia M. Thi 教授and Marcia Urban-Maldonado教授。
文章摘要
我们用编码 hTERT 的慢病毒载体转导了从四窝胚胎野生型 (WT) 和 无connexin 43 (Cx43) 小鼠幼崽培养的小鼠皮质星形胶质细胞,并测量了星形胶质细胞特异性标志物的表达直至第 10 代 (p10)。由此产生的永生化细胞系(分别称为 IWCA 和 IKOCA)表达的生物标志物与新生小鼠星形胶质细胞的生物标志物一致,包括来自野生型但不来自 Cx43 缺失小鼠的 Cx43、缺乏 Cx30 和存在 Cx26。 AQP4 是在星形胶质细胞端足中发现的高丰度水通道,在早期传代中表达水平适中,其 mRNA 和蛋白质下降至低水平,但 p10 仍可检测到。星形胶质细胞生物标志物醛脱氢酶 1L1 (ALDH1L1)、谷氨酰胺合成酶 (GS) 和胶质纤维酸性蛋白 (GFAP) 的 mRNA 水平在连续传代期间保持相对恒定。 GS 蛋白表达得以维持,而 GFAP 随着细胞传代而下降,但在 p10 时仍可检测到。谷氨酸转运蛋白 1 (GLT-1) 的 mRNA 和蛋白质水平均随传代次数而下降。相应时间的免疫染色与蛋白质印迹的数据一致,并提供了这些蛋白质在适当的细胞内位置表达的证据。与我们生成 Cx43 功能性表达或缺失的永生化细胞系的目标一致,发现 IWCA 细胞在细胞间染料转移方面耦合良好,并且在连接形成的时间过程、电耦合方面与原代星形胶质细胞培养相似强度和电压灵敏度。此外,在 IWCA 细胞系与 bEnd.3 微血管内皮细胞的共培养中,屏障功能得到了增强。此外,免疫染色显示 IWCA 中的扁平内源性 Cx43 间隙连接斑块在外观上与用荧光蛋白标记的 Cx43 转染 IKOCA 细胞后获得的斑块相似。 IKOCA 细胞中 Cx43 的重新表达允许对连接蛋白进行实验操作和实时成像之间的相互作用 连接蛋白和其他蛋白质。我们得出结论,这些细胞系的特性类似于原代培养的星形胶质细胞,它们可以通过在适合星形胶质细胞的细胞环境中促进遗传和药理学操作,为功能研究提供有用的工具。
研究背景
脊椎动物间隙连接 (GJ) 由连接蛋白家族形成。 GJ 通道在相邻细胞之间提供载流离子、代谢底物和信号分子的直接胞质交换。最广泛和最丰富的 GJ 蛋白是连接蛋白 43 (Cx43),它是大脑中心肌细胞、脉管系统和星形胶质细胞之间的主要 GJ 蛋白。通过 Cx43 GJs 进行的细胞间通讯在其表达的组织中介导关键的基本功能,包括整个心脏的收缩传播、神经前体细胞迁移过程中的信号传导以及通讯隔间中细胞功能的协调。因为它是一种丰富的 GJ 蛋白,所以当第一只 Cx43-null 小鼠产生时,纯合的无效幼崽在出生后不久就死亡也就不足为奇了(Reaume 等,1995)。令人惊讶的是,围产期死亡率不是整个心脏节律传播紊乱的结果,而是由于延迟的神经嵴细胞迁移和随后的左心室流出道发育缺陷(Lo和Wessels,1998)。因此,Cx43-null 小鼠左右心室之间的卵圆孔在出生时不会关闭。因此,Cx43-null 小鼠存活到胎盘循环结束,此时动物不再充分灌注。为了研究缺乏 Cx43 表达的细胞的特性,我们维持了 Cx43 杂合子的繁殖菌落多年,以便我们可以在分娩后立即从野生型和 Cx43-null P0 幼崽或 E19-20 获得组织并制备原代细胞培养物通过剖腹产获得的幼崽(Scemes 等人,1998 年)。该方案成本高昂且效率低下,因为这些转基因小鼠的繁殖是不规则的,并且在验证基因型之前必须从每只小鼠中分别制备细胞培养物。为了避免这些困难,我们投资于产生永生化星形胶质细胞,这对于允许使用具有和不具有 Cx43 表达的培养星形胶质细胞以获得更高的传代次数非常有益,并符合缩写:ALDH1L1,10-甲酰基四氢叶酸脱氢酶; DiI, 1,1-dioctadecyl-3,3,33-tetramethylindocarbocyanine perchlorate; AQP4,水通道蛋白4; bEnd.3 细胞,来自小鼠 ATCC R CRL-2299TM 的脑微血管内皮细胞系; Cx43,连接蛋白43; Cx30,连接蛋白30; Cx26,连接蛋白26; EBFP2,增强型蓝色荧光蛋白 2,FRAP,光漂白后的荧光恢复; GS,谷氨酰胺合成酶; GFAP,胶质酸性纤维蛋白; GJ、GLT-1 (EAAT2)、谷氨酸转运蛋白 1(兴奋性氨基酸转运蛋白 2):间隙连接; hTERT,人类端粒酶逆转录酶; IWCA,永生化的野生型皮质星形胶质细胞; IKOCA,永生化 Cx43-null 皮质星形胶质细胞; msfGFP,单体化超级文件夹绿色荧光蛋白; qRT-PCR,定量实时聚合酶链反应; sfGFP,超级文件夹绿色荧光蛋白。细胞神经科学前沿| www.frontiersin.org 2 用于实验动物模型的三个“R”(减少动物数量、优化技术以最大程度地减少疼痛以及在可能的情况下替换动物实验),同时节省时间、金钱并减少实验室材料浪费。我们用 hTERT 转导了来自 Cx43-null 和野生型同窝小鼠的皮质星形胶质细胞的原代培养物。如我们之前所述(Thi 等人,2010),该方法已成功用于生成其他细胞系,包括野生型和 Cx43-null 成骨细胞系。此外,据报道,hTERT 转导与癌基因转染相比具有优势,因为它不涉及肿瘤抑制基因的失活(Lee 等,2004)。在这份手稿中,我们报告了源自野生型和 Cx43-null 小鼠的 hTERTimmortalized 星形胶质细胞系的特征,命名为 IWCA 和永生化 Cx43-null 皮质星形胶质细胞 (IKOCA) 细胞,关于星形胶质细胞特异性 mRNA 和蛋白质的表达以及几个不同的功能特性。我们还证明了在 IKOCA 细胞中外源表达的由 Cx43 形成的 GJ 斑块在外观上与在野生型原代星形胶质细胞培养物中表达的 GJ 斑块相似,表明这些细胞系可用于研究细胞和分子操作对星形胶质细胞结构的影响和功能。
研究内容
1.WT 和 Cx43-Null 星形胶质细胞原代培养物中星形胶质细胞标志物表达水平的量化,以及用 hTERT 转染每种基因型后的通道在 IWCA 星形胶质细胞中发现 Cx43 转录物表达随着时间的推移相对恒定,并且在 IKOCA 空值中根本无法检测到(图 1A)。 Cx30 水平太低,无法在所有通道的两种基因型中量化(图 1B),而 Cx26 丰度在两种基因型中相对恒定,直至第 10 代(图 1C)。水通道蛋白 4 (AQP4) mRNA 表现出类似的持续表达,尽管不同细胞系中的水平差异很大(图 1D)。我们检查的其他星形胶质细胞标志物包括谷氨酰胺合成酶 (GS)、醛脱氢酶 1(10-甲酰基四氢叶酸脱氢酶,ALDH1L1)、谷氨酸转运蛋白 1 [GLT-1、人兴奋性氨基酸转运蛋白 2 (EAAT2) 的小鼠直系同源物,也称为溶质载体家族 1 成员 2 (SLC1A2)] 和胶质纤维酸性蛋白 (GFAP)。 GS、ALDH1L1 和 GFAP 随着时间的推移,在两种基因型的培养中,发现其 mRNA 表达水平几乎恒定(图 1E、F、H)。 GLT-1 的表达存在于两种基因型的两个细胞系中,而在其他 2 个细胞系中低于检测(图 1G)。
进行蛋白质印迹和免疫染色以量化蛋白质表达水平并确定 IWCA 和 IKOCA 在第 1-10 段的细胞定位。图 2A-C 中显示了代表性通道中 Cx43 的免疫印迹和免疫染色,图 2A-D 中显示了 AQP4。在 IWCA 培养物中,Cx43 蛋白水平直到第 5 代才显着降低,但在第 10 代降低到其初始水平的约 30%(图 2C)。在免疫染色培养物或从 IKOCA 获得的免疫印迹中的任何时间点都未检测到 Cx43。免疫染色和蛋白质印迹均显示 IKOCA 中的 AQP4 蛋白水平在第 1 代时低于 IWCA 星形胶质细胞,并且从第 1 代开始两种基因型的 AQP4 蛋白水平逐渐下降;在第 5 代及以后,基础 AQP4 表达非常低(图 2D)。还确定了 GFAP 和 GS(其他两种特征性星形胶质细胞标志物)的表达水平和细胞定位。与图 1 所示的 mRNA 结果相似,在所有通道的 IWCA 和 IKOCA 中均可检测到 GFAP 染色(图 3A、B),但蛋白质水平随时间下降(图 3C)。然而,IKOCA 中 GFAP 蛋白表达的下降比 IWCA 更快,正如 im 所揭示的,在两种基因型的培养中,随着时间的推移,mRNA 表达水平几乎恒定(图 1E、F、H)。 GLT-1 的表达存在于两种基因型的两个细胞系中,而在其他 2 个细胞系中低于检测(图 1G)。进行蛋白质印迹和免疫染色以量化蛋白质表达水平并确定 IWCA 和 IKOCA 在第 1-10 段的细胞定位。图 2A-C 中显示了代表性通道中 Cx43 的免疫印迹和免疫染色,图 2A-D 中显示了 AQP4。在 IWCA 培养物中,Cx43 蛋白水平直到第 5 代才显着降低,但在第 10 代降低到其初始水平的约 30%(图 2C)。在免疫染色培养物或从 IKOCA 获得的免疫印迹中的任何时间点都未检测到 Cx43。免疫染色和蛋白质印迹均显示 IKOCA 中的 AQP4 蛋白水平在第 1 代时低于 IWCA 星形胶质细胞,并且从第 1 代开始两种基因型的 AQP4 蛋白水平逐渐下降;在第 5 代及以后,基础 AQP4 表达非常低(图 2D)。
还确定了 GFAP 和 GS(其他两种特征性星形胶质细胞标志物)的表达水平和细胞定位。与图 1 所示的 mRNA 结果相似,在所有通道的 IWCA 和 IKOCA 中均可检测到 GFAP 染色(图 3A、B),但蛋白质水平随时间下降(图 3C)。然而,免疫印迹显示,IKOCA 中 GFAP 蛋白表达的下降比 IWCA 更快(图 3C)。 GS 在 IWCA 和 IKOCA 中显示出强烈的免疫染色,直到第 10 代(图 3A,B)。西方免疫印迹检测到 IWCA 和 IKOCA 培养物中的 GS 明显增加,直到第 5 代,此后下降(图 3D)。方差很大,通过 ANOVA 评估,基因型之间或随时间的差异并不显着。

Fig. 1. 图 1 |定量 RT-PCR 显示转导后 10 次传代期间编码星形胶质细胞蛋白的 mRNA 的表达水平。永生化野生型 (IWCA) 和 Cx43-null (IKOCA) 皮质星形胶质细胞系中星形胶质细胞生物标志物的表达水平。在用 hTERT 转导后最多 10 代的每个时间点测量的表达水平被标准化为转导前 IWCA 星形胶质细胞的表达水平(在直方图中标记为第 1 代)。直方图中的点对应于单个细胞系和条形,方差对应于为两种基因型中的每一种生成的四个独立克隆的平均值 ± SE 值。 (A) Cx43 水平在 IWCA 中稳定多达 10 代,而在所有 IKOCA 系中均不存在 Cx43 表达。 (B) 在永生化之前或之后的任何时间点,在 IWCA 或 IKOCA 中均未检测到 Cx30。 (C) Cx26 存在于 IWCA 和 IKOCA 中,并且在两种基因型中都相对稳定,并持续传代。 (D) IWCA 和 IKOCA 中 AQP4 转录物的水平,第 10 代的最低水平约为原代细胞的 20%。 (E,F) 星形胶质细胞标志物谷氨酰胺合成酶 (GS) 和醛脱氢酶 (ALDH1L1) 的转录水平在检查的 10 代中非常稳定。 (G) 谷氨酸转运蛋白 (GLT1) 的 mRNA 低于原代细胞,但基因型之间相似,并且在两种基因型的第 5 代后下降,在第 10 代达到不可检测的水平。(H) 星形胶质细胞中间丝转录物 GFAP 的水平是稳定的在两种基因型中,但在第 10 代的两种 IKOCA 细胞系中含量较低。

图2. 在前十代中,Cx43 和 AQP4 在 IWCA 和 IKOCA 中的表达水平和定位。 (A,B) 永生化 WT (IWCA) 和 Cx43-null (IKOCA) 皮质星形胶质细胞培养物中 Cx43 的免疫染色显示 IWCA 中的点状细胞间定位不太丰富,但随着时间的推移在培养中仍然很突出。 IKOCA 在任何时间点均未显示 Cx43 免疫染色。 AQP4 的点状分布表明该蛋白在 IWCA 和 IKOCA 中的第 10 代仍然很好地表达,但降低到非常低的水平。注意:细胞核染色中的点状染色是非特异性的,可能是 AQP4-C19 抗体的伪影,如前所述 (Thi et al., 2008)。比例尺为 20 µm,图中所有显微镜图像的比例相同。 (C) 蛋白质印迹显示 IWCA 中的 Cx43 蛋白水平在第 10 代之前没有显着下降,当时其水平降低到原代星形胶质细胞的 30% 左右。 IKOCA 在所有时间点均不存在 Cx43 蛋白表达。 (D) AQP4 蛋白表达非常低,但在第 5 代及以上两种基因型中均可检测到。

图 3 |前十代中 GFAP 和 GS 在 IWCA 和 IKOCA 中的表达水平和定位。 (A,B) IWCA 和 IKOCA 的 GFAP 免疫染色随着时间的推移而下降。 GS 在所有传代的 IWCA 和 IKOCA 培养物中均高度表达,但在两种基因型中的第 5 代均下降。比例尺为 20 µm,图中所有显微镜图像的比例相同。 (C) GFAP 蛋白水平也随着逐步传代迅速下降,IWCA 中的最低水平约为 27%,IKOCA 培养中约为 2%。 (D) GS 蛋白水平在培养中随着时间的推移而增加,在所有时间点都有些变化。
2. 永生化皮质星形胶质细胞系中 Cx43 功能的评估
我们的永生化程序的主要目标是获得正常星形胶质细胞和缺乏主要 GJ 蛋白 Cx43 表达的星形胶质细胞,这将为评估 Cx43 在星形胶质细胞行为的多个方面的作用提供一个理想的工具。为了确保功能性 Cx43 表达在永生化星形胶质细胞中持续多次传代,我们测量了小荧光染料 LY (MW 444 Da) 和钙黄绿素 (MW 622 Da) 的细胞间转移。为了量化与 LY 的耦合强度,我们在融合培养皿中注入了单个细胞。如图 4A 所示,在第 9-10 代 LY 转移在 IWCA 之间很常见,从注入的细胞扩散到其相邻细胞的 13.7 ± 2.8%(图 4C),每个字段总共有 535 ± 100 个细胞。 IKOCA 培养物中的 LY 转移几乎不存在(图 4B),从注入的细胞扩散到仅 1.0 ± 0.1% 的相邻细胞(图 4C),每个字段总共有 102 ± 27 个细胞。染料转移也使用所谓的“降落伞试验”进行了评估。在本次检测中,将载有 GJ 可渗透染料钙黄绿素和亲脂性 GJ 不可渗透膜染料 DiI 的第 7-10 代分离供体细胞逐滴添加到第 7-10 代受体细胞的单层上。在添加供体细胞后 1-2 小时观察到偶联。如图 4D、G 所示,每个供体 IWCA 细胞在 IWCA 受体培养物中平均招募了 24.36 ± 8.95 个相邻细胞,证实了 LY 注射试验的结果,证明 IWCA 在功能上是耦合的。未观察到 IWCA 和 IKOCA 之间的异细胞偶联(图 4E,G),并且 Cx43 缺陷型 IKOCA 未显示同细胞偶联(图 4F,G)。
使用全细胞电压钳方法的电生理记录提供了测量 GJ 介导的耦合的最灵敏和定量的方法,因此揭示的生物物理特性可以指示哪些连接蛋白形成通道(del Corsso 等人,2006)。来自 IWCA(通道 >10)的成对全细胞记录响应长电压脉冲显示,当任一极性的电压较低时,结电流随时间保持恒定,但在电压脉冲高于约 ±40 mV 时电流下降(图 4H)。结电导的这种微弱但明显的电压敏感性与在用 Cx43 转染的细胞系中测量的相似(Moreno 等,1995)。在 IKOCA(通道 >10)中,耦合的细胞对较少,连接电导低得多(图 4I)。在 IWCA 中计算的结电导在 17 个细胞对中为 17.5 + 3.2 nS,而在 23 个 IKOCA 细胞对中为 0.36 + 0.18 nS,差异显着(p < 0.0001)。
染料偶联和电生理研究的结果表明 IWCA 保留了形成功能性 Cx43 GJ 通道的能力。在 IKOCA 中,无法形成功能性 Cx43 GJ 预计仅归因于缺乏 Cx43 表达。为了证明组装和形成 Cx43 GJ 所需的细胞机制也保留在 IKOCA 中,我们用 GFP 标记的 Cx43 转染这些细胞,并将 GJ 斑块形成与 IWCA 的形成进行比较。如图 5A 所示,GJ 勾勒出 IWCA 的边缘,但在未转染的 IKOCA 中完全不存在(图 5D)。在 IWCA 中,内源性 Cx43 GJ 斑块在更高放大倍率下观察时似乎由一些离散的较小斑块组成(图 5B,C)。同样,用 GFP 标记的 Cx43 转染的 IKOCA 中的 Cx43 斑块显示为包含圆形亚基的扁圆结构域(图 5E,F)。图 5E 中具有较暗但可检测到的 GFP 信号的细胞区域代表非连接 sfGFP-Cx43,当使用共聚焦显微镜在高放大倍率下以 3D 观察时,可以识别出主要位于质膜上。 Cx43 的总体表达增加和更大的 GJ 斑块结构代表了在 IWCA 星形胶质细胞中发现的外源性连接蛋白和内源性表达的 Cx43 的显着差异。这些结果表明,Cx43-null 星形胶质细胞的永生化不会损害这些细胞形成 GJ 的能力,并且转染 GFP 标记的 Cx43 的 IKOCA 中 GJ 斑块的组织类似于 IWCA 之间内源性表达的 GJ 斑块。最重要的是,这个发现表明 IKOCA 细胞系可能是一种有用的底物,其中 Cx43 GJ 及其变体可以在星形胶质细胞背景中表达,以模拟正常细胞环境为了研究 Cx43 变体表达对细胞生理学和形态学的影响,不存在内源性 Cx43 表达的混淆。

图 4 |在融合的皮质星形胶质细胞培养物中评估永生化 WT (IWCA) 和 Cx43-null (IKOCA) 中的功能 GJ 耦合。 (A) 在第 10 段观察到的 IWCA 之间的荧光黄 (LY) 染料耦合。左,明亮的视场相衬图像,带有叠加的荧光。正确的;带有星号的荧光图像,表示微量注射 LY 的细胞;注意在所有直接相邻的邻居中检测到间隙连接介导的染料扩散。比例尺 = 40 µm (B)。在第 10 段 IKOCA 之间未观察到 LY 染料偶联。左侧,亮相加荧光显示注射视野。右图:在 IKOCA 培养物中,染料不会从注入的细胞扩散到相邻的相邻细胞中。比例尺 = 40 µm (C)。 LY 染料在 IWCA 和 IKOCA 培养物中扩散的量化。直方图对应于每个基因型在第 10 代时在每个基因型的两个独立培养物中进行的六次注射的平均值 ± SEM (∗∗∗∗p < 0.001)。 (D-F)。降落伞试验:(D)从 IWCA 第 9 代供体到受体 IWCA 细胞(IWCA-IWCA); (E) 从 IWCA 供体到受体 IKOCA 第 10 代细胞 (IWCA-IKOCA),和 (F) 从 IKOCA 第 10 代供体到受体 IKOCA 细胞。通过双钙黄绿素-DiI(分别为绿色和红色)标记识别供体细胞。比例尺 = 20 µm (G) 钙黄绿素染料在 IWCA-IWCA、IWCA-IKOCA 和 IKOCA-IKOCA 供体-受体培养物中的定量。偶联被评估为每个供体细胞的偶联细胞数。 (H) 使用 IWCA 和 IKOCA 电池对之间的双全电池电压钳测量的结电流。缓慢的电压斜坡(插图,–100 mV 到 +100 mV 超过 5 s)被传送到单元 1,同时记录单元 1(I1,上迹线)和单元 2 中的电流(在单元 2 中记录电流,同时向单元 1 提供电压与结电流等效,但极性相反,标记为 Ij)。来自 IWCA 对(左下轨迹)的结电流很大,并且显示出与 Cx43 通道的电压依赖性一致的电压非线性。 IKOCA 对的结电流非常小,表明细胞没有高度耦合。 (I) IWCA 和 IKOCA 电池对中结电导 (gj = Ij/V) 的量化。请注意,与 IKOCA 相比,WCA 中的 gj 明显更强(17.35 + 3.2 nS,N = 17 vs 0.36 + 0.18 nS,N = 23;p < 0.0001)。

图 5 |永生化 WT 皮质星形胶质细胞 (IWCA) 中的内源性 Cx43 GJ 斑块与永生化 Cx43-null 皮质星形胶质细胞 (IKOCA) 中由 GFP 标记的 Cx43 形成的 GJ 斑块的比较。 (A, B) GJ 斑块 (箭头) 勾勒出单个 IWCA (由 DAPI 染色的细胞核识别)。比例尺 = 20 µm。 (C) 在更高的放大倍数下,这些连接区域看起来有点扁,由紧密堆积的斑块形成。比例尺 = 5 µm。 (D) 在 IKOCAs 中,内源性 Cx43 连接不存在。 (E) 用 GFP 标记的 Cx43 转染 IKOCA 细胞诱导形成标记的间隙连接斑块。比例尺 = 20 µm。 (F) 来自“E”的更高放大率图像。比例尺 = 5 µm。
3. IKOCA 细胞允许对间隙连接斑块形态和与其他细胞器的相互作用进行超分辨率成像
使用 Zeiss 980 Airyscan2 显微镜对连接两个 IKOCA 细胞的 EBFP2-Cx43(图 6 中免疫染色的绿色)囊泡(绿色斑点)和 GJ 斑块的位置进行成像,以检查 GJ 斑块形态特征,例如不连续性和小的相邻 GJ 斑块(放大插图在图 6A)。请注意图 6A 中所示 GJ 斑块边缘附近的明亮小斑点,其中的形态让人想起之前通过电子显微镜和其他人在转化细胞系中观察到的萌芽内吞 GJ(Bell 等人, 2018)。 GJs 与线粒体以及与其他细胞器之间的相互作用改变了细胞间的通讯(Wang 等人,2013;Kang 等人,2014)。如图 6 所示,培养物中某些 IKOCA 细胞中 Cx43 的重新表达允许比较 IKOCA 细胞中 Cx43 表达对线粒体位置和形态的影响。在这里,我们显示所有线粒体的后固定免疫荧光染色。注意线粒体明显定位于 EBFP2-Cx43 斑块区域(图 6C 显示反射性 Cx43 GJ 斑块,白色箭头),该斑块部分正在进行内吞作用,小线粒体可能位于 GJ 斑块的大内吞部分(GJ 内体也已知作为连接体)。连接体相关的线粒体在图 6D 中用黄色箭头表示。星形胶质细胞膜折叠但未被 GJ 斑块占据的区域由图 6C 中小白色箭头旁边的微弱但增强的绿色信号指示。这些数字突出了 IKOCA 和 IWCA 星形胶质细胞在高分辨率成像中的实用性。

图 6 | IWCA 和 IKOCA 细胞可用于通过超分辨率显微镜研究 GJ 形态和与其他蛋白质的相互作用。 (A) 当两个转染细胞接触时,IKOCA 第 10 代细胞转染以重新表达 Cx43,并带有荧光蛋白标签(绿色,用针对 Cx43 的抗体进行免疫标记)形成 GJ。如蓝色 DAPI 染色所示,在 A 中图像的场中心有未转染的细胞与两个转染的 IKOCA 细胞接触,它们不表达 Cx43 并且不形成 GJ(比例尺 = 20 µm)。超分辨率成像可以深入了解 GJ 斑块和内吞 GJ 斑块的结构特征,如放大插图(比例尺 = 2 µm)所示。 (B) 在 IKOCA 细胞亚群中重新表达标记为 Cx43 的荧光蛋白,随后对所有 IKOCA 细胞(例如线粒体)中存在的次级细胞特征进行免疫染色,从而可以研究 Cx43 表达在星形胶质细胞样细胞中的影响。细胞培养样品 - 使用超分辨率显微镜(比例尺 = 20 µm)促进 Cx43 和其他细胞器之间相互作用的并排比较和可视化。 (C) 放大 Cx43 GJ 斑块结构(绿色,用白色箭头表示)似乎与小线粒体相互作用的位置(用 TOMM20 染色表示,洋红色)。该 GJ 斑块代表反射性 GJ 斑块,该斑块已在同一星形胶质细胞的质膜重叠处形成,从而允许 GJ 形成。 (D) 与“C”中相同区域的视图。移除 Cx43 通道以允许观察内吞 Cx43 连接体(黄色箭头)内的 TOMM20 染色 - 提高线粒体转移可能通过 Cx43 内吞作用发生的可能性。 (C,D)中的比例尺 = 2 μm。
4. IKOCA 细胞允许对 GJ 和相互作用蛋白进行光学实验
三维 FRAP(如图 7A 所示)允许改进对 GJ 内斑块蛋白迁移率的评估,因为可在 3D FRAP 中检测到可用于恢复的整个有效(对于此时间尺度)荧光池。其他 GJ 特征的运动,例如当 GJ 的一部分被内吞时形成的不连续性,可以使用共聚焦显微镜在永生化星形胶质细胞中轻松研究。 Cx43 在 GJ 斑块结构中的排列比其他蛋白质(如 Cx30 和 Cx26)更稳定,如先前在转化细胞系中报道的(Stout 等,2015)。培养的 IKOCA 和 IWCA 细胞薄而扁平的形态导致它们产生 GJ 斑块,这些斑块通常与生长基质(盖玻片)几乎平行排列。这些特性使 IKOCA 和 IWCA 细胞成为活体 3D 显微镜和 GJ 和细胞内细胞器的超分辨率成像的理想选择。能够完全替代 IKOCA 细胞中缺失的 Cx43 表达带有荧光蛋白标记的 Cx43 允许在兼容的颜色通道中共表达带有荧光蛋白标记的其他感兴趣的蛋白质。图 7B 显示了一对 IKOCA 细胞的 3D 延时图像的正交最大强度投影,该细胞由正在部分经历的蓝色荧光(伪洋红色)EBFP2-Cx43 GJ 斑块连接内吞作用。细胞与 msfGFP-ATG9A(绿色)共转染。 ATG9A 先前被证明与 Cx43 的内吞过程相互作用并共定位于质膜(Bejarano 等人,2014),但 ATG9A 阳性的小囊泡样结构明显转移到 Cx43 GJ 斑块的部分。内吞作用起始点(图 7B,放大插图)以前没有报道过,并且在没有 IKOCA 细胞的情况下很难在星形胶质细胞样细胞中观察到。

图 7 | IKOCA 细胞中修饰的 Cx43 转基因的表达可以在没有内源 Cx43 表达的混杂影响的情况下实时可视化,并允许测试 Cx43 突变体的表达和其他处理对 IWCA 的影响。 (A) sfGFP-Cx43 和其他荧光蛋白标记的连接蛋白的表达允许 3D 时间推移 FRAP 实验来检查星形胶质细胞样细胞中的 GJ 斑块动力学 (IKOCA 第 18 段)。星形胶质细胞的薄形态有助于 3D、延时 FRAP,因为 GJ 斑块通常与成像焦平面几乎平行地形成。对于所示的示例图像,使用 11 个共焦平面对 GJ 的整个垂直宽度进行成像,每个堆栈以 3 秒的间隔采集。由此产生的 Z 堆叠被折叠成一系列最大投影重建,以可视化整个斑块结构随时间的荧光恢复。比例尺 = 2 µm。 (B) EBFP2-Cx43 与绿色荧光蛋白标签和传感器的表达允许对 Cx43 和其他细胞成分(如 msfGFP-ATG9A)之间的相互作用进行实时 4D 检查,显示为延时蒙太奇的最大投影(IKOCA 第 16 段,比例尺条 = 5 µm)。请注意,EBFP2-Cx43 GJ 斑块以洋红色显示,msfGFP-ATG9A 自噬蛋白以绿色显示。放大的插图显示了 IKOCA 星形胶质细胞中转基因表达的 Cx43 和 ATG9A 之间动态相互作用的细节。插入比例尺 = 1 µm。
5.通过与 IWCA 的共培养增强了内皮单层中的屏障形成
为了评估永生化星形胶质细胞系是否保留其与内皮细胞功能相互作用的能力,如在血脑屏障水平上观察到的,我们对与内皮 bEnd.3 细胞共培养的 IWCA 进行了研究。基于使用 CellZscope 设备监测数天的跨内皮电阻 (TEER) 的发展来评估屏障形成。如图 8 所示,有和没有 IWCA 的 bEnd.3 内皮细胞培养物的 TEER 随着培养时间的增加而增加。然而,从测量开始并持续到第 7 天,使用 IWCA 培养 bEnd.3 细胞的 TEER 显着高于单独使用 bEnd.3 或与 IKOCA 一起培养的 TEER(p 值 < 0.05)。从第 1 天开始, TEER (Ohm cm2) 的与 IWCA 的共培养显着高于单独的 bEnd.3 细胞 (7.31 ± 1.13 vs 1.67 ± 0.28, p = 0.00024) 和 IKOCA 与 bEnd.3 (7.31 ± 1.13 vs 4.33 ± 0.63, p = 0.033)。在第 7 天,与单独的 bEnd.3 细胞(23.17 ± 2.60 vs 9.34 ± 0.86,p = 0.00027)和 IKOCA 与 bEnd.3(23.17 ± 2.60 vs 12.56 ± 1.13,p = 0.0022)相比,差异仍然存在。这些 IWCA 共培养 TEER 值与其他人先前在使用连接到 EVOM 电阻计 (Srinivasan) 的 Endohm 室与原代大鼠星形胶质细胞共培养 5 天时报告的值相似等人,2015)。

图8. Transwell 电阻 (TEER) 在单独的 bEnd.3 内皮细胞和与永生化 WT (IWCA) 和 Cx43-null (IKOCA) 皮质星形胶质细胞的共培养中测量。使用 CellZscope 测量单独 bEnd.3 细胞的 transwell 培养物以及与 IWCA 和 IKOCA 共培养物的电阻增加。 N = 11-17 个单独的实验。通道数范围为 15-30。 ∗∗∗p < 0.01, ∗∗∗p < 0.001, ∗∗∗∗p < 0.0001 表示与单独的 bEnd.3 单元格相比的显着性。 ∧p < 0.05, ∧∧p < 0.01, ∧∧∧p < 0.001, ∧∧∧∧p < 0.0001 表示相对于 bEnd.3 + IKOCA 的显着性。混合效应分析用于测试每个时间点的显着性。
材料方法
以下内容请下载文献详情。